TLE- SPE-SPC-ANALYSER UN SYSTEME PAR DES METHODES CHIMIQUES
Publié le 27/05/2024
Extrait du document
«
TLE- SPE-SPC-ANALYSER UN SYSTEME PAR DES METHODES CHIMIQUES
Objectifs : poursuivre le travail amorcé en seconde et en spécialité de première, consistant à déterminer la
composition d’un système, en exploitant des méthodes chimiques, c’est-à-dire pour lesquelles il y a une
transformation chimique.
12/09/2023
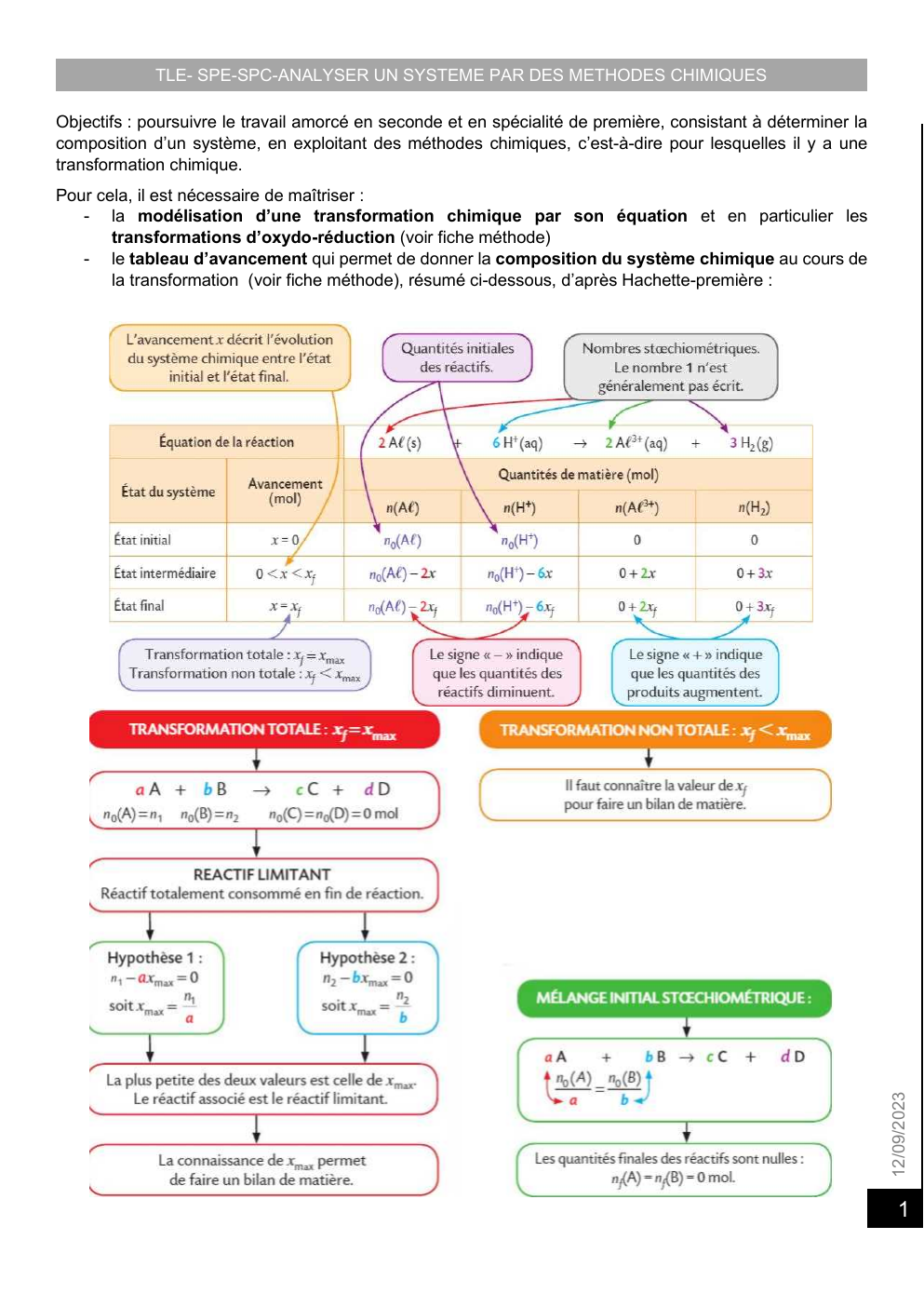
Pour cela, il est nécessaire de maîtriser :
- la modélisation d’une transformation chimique par son équation et en particulier les
transformations d’oxydo-réduction (voir fiche méthode)
- le tableau d’avancement qui permet de donner la composition du système chimique au cours de
la transformation (voir fiche méthode), résumé ci-dessous, d’après Hachette-première :
1
TLE- SPE-SPC-ANALYSER UN SYSTEME PAR DES METHODES CHIMIQUES
la notion de titrage et d’équivalence du titrage, d’après Hachette-première
la réaction d’un titrage doit être totale, rapide et unique !
A faire : Exercices p 62 n°5 et 6
12/09/2023
-
2
TLE- SPE-SPC-ANALYSER UN SYSTEME PAR DES METHODES CHIMIQUES
Correction n°5
1.
Pour identifier réactif titré (à titrer, donc celui dont on cherche la quantité ou la concentration) et réactif
titrant, analyser l’énoncé : « on veut contrôler la composition en ions Ca2+(aq) » donc c’est Ca2+(aq) qui
est le réactif titré.
« un titrage par une solution d’hydroxyde de sodium Na+(aq) + HO-(aq) » donc cette
solution contient le réactif titrant (celui par qui le titrage s’effectue)
L’équation du titrage ne fait apparître que les ions HO-(aq) et pas Na+(aq).
On en déduit que HO-(aq) est
le réactif titrant (Na+(aq) sont spectateurs)
2.
La réaction support d’un titrage doit être totale, rapide et unique.
3.
A l’équivalence, les réactifs sont introduits dans les proportions stoechiométriques, donc un tableau
d’avancement amène nf(Ca2+) = 0 et nf(HO-) = 0 avec nf(Ca2+) = ni(Ca2+) – xmax et nf(HO-) = ni(HO-) –
2 xmax.
donc xmax = ni(Ca2+) = ni(HO-) / 2 (relation à l’équivalence)
Avec ni(Ca2+) = m0(Ca2+) / M(Ca2+) et ni(HO-) = nE(HO-)
Alors m0(Ca2+) / M(Ca2+) = nE(HO-) / 2 est l’expression correcte de la relation à l’équivalence.
12/09/2023
Correction n°6
1.
A l’équivalence, les réactifs sont introduits dans les proportions stoechiométriques, donc un tableau
d’avancement amène nf(C4H4O4) = 0 et nf(HO-) = 0 avec nf(C4H4O4) = ni(C4H4O4) – xmax et nf(HO-) =
ni(HO-) – 2 xmax.
donc xmax = ni(C4H4O4) = ni(HO-) / 2 (relation à l’équivalence)
Donc n1(C4H4O4) = nE(HO-) / 2
2.
Avec nE(HO-) = [HO-] x VE = cB x VE et n1(C4H4O4) = c x V1
Alors c = cB x VE / V1 = 1,00 x 10-2 x 15,7 / 10,0 = 1,57 x 10-2 mol.L-1
3
TLE- SPE-SPC-ANALYSER UN SYSTEME PAR DES METHODES CHIMIQUES
Comment détecter l’équivalence d’un titrage ?
-
Changement de couleur dû à l’apparition et/ou disparition d’une espèce chimique colorée (déjà
rencontré en première)
Ajout d’une entité colorée (indicateur coloré) qui n’a pas la même couleur avant et après
l’équivalence (vu dans chapitre ultérieur)
A l’aide d’un graphique obtenu par un suivi conductimétrique ou un suivi pH-métrique (voir
ultérieurement).
A connaître : suivi conductimétrique d’un titrage
La réaction support du titrage doit impliquer des espèces ioniques.
Le montage est celui d’un titrage complété par le conductimètre, dont l’électrode plonge dans la
solution titrée.
On ajoute un grand volume d’eau distillée (100 à 200 mL) afin de pouvoir négliger l’effet de dilution
au cours du titrage.[A chaque volume de solution titrante versée, la concentration des espèces présentes,
ne doit varier qu’en raison de la réaction de titrage et pas parce que le volume global est modifié]
On mesure la conductivité de la solution au fur et à mesure que la solution titrante est versée, pour obtenir
le graphique :
L’évolution de la conductivité en fonction du volume Mesurer le volume équivalent :
versé de solution titrante, doit présenter une On trace les deux portions de droite.
Et on lit le
rupture de pente.
volume équivalent à leur intersection.
Si l’effet de dilution ne peut être négligé, on Avec Latispro, cliquer droit sur la zone graphique :
n’observe pas deux portions de droite mais plutôt possibilité de tracer des droites et noter
leurs
deux courbes.
équations mathématiques ou d’utiliser le réticule.
A faire : exercices p 63 n°8, 9 et 10
Correction n°8
Correction n°9
1.
On trace les deux portions de droite et on lit le volume versé à l’équivalence, à leur intersection.
VE =
6,8 mL
2.
A l’équivalence ni(C9H8O4) = nE(HO-) avec ni(C9H8O4) = cA x VA et nE(HO-) = [HO-] x VE
Donc cA = [HO-] x VE / VA = 2,0 x 10-2 x 6,8 / 10,0 = 1,4 x 10-2 mol.L-1
12/09/2023
1.
On lit en ordonnée des valeurs comprises entre 0 et 0,028.
Puisque les valeurs habituelles du pH
sont comprises entre 0 et 14, alors la grandeur mesurée est la conductivité et pas un pH.
2.
Donc on en déduit qu’il ne s’agit pas d’une courbe de suivi pH-métrique mais d’un suivi
conductimétrique.
3.
Voir rappel + ajout conductimètre.
4
TLE- SPE-SPC-ANALYSER UN SYSTEME PAR DES METHODES CHIMIQUES
Correction n°10
Si on a obtenu un volume versé à l’équivalence pour un titrage avec suivi pH-métrique, on doit obtenir le
même volume à l’équivalence (10,0 mL) pour le même titrage (même réaction support) avec un suivi
conductimétrique.
On applique dans un premier temps la méthode pour obtenir le volume versé à l’équivalence dans le cas du
suivi conductimétrique.
On lit VE = 10 mL pour le graphique de gauche et 11 mL pour le graphique de droite.
Donc a priori on obtiendrait plutôt le graphique de gauche.....
»
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- Sujets Grand oral spe maths
- SPE anglais monde contemporain quelle est la situation des amérindiens aujourd’hui?
- SVT SPE 1er: Activité : Origine multifactorielle d'un cancer
- le systeme de la nature cours et analyse
- explication de texte: John Locke a écrit en 1690 un essai philosophique concernant l’entendement humain, nous allons analyser un extrait du livre II, chapitre 27, paragraphe 26