exercice pour reviser
Publié le 27/12/2024
Extrait du document
«
Ch.5
titrages colorimétriques - exercices
STC
Problème n°1 : Teneur en fer d’un produit phytosanitaire (E3C) :
Les feuilles de certaines plantes comme celles des vignes, des rosiers, des pêchers peuvent parfois jaunir tout en gardant
des nervures bien vertes.
C’est le signe que ces plantes souffrent de chlorose ferrique.
Le fer, comme le magnésium, le
manganèse ou le zinc sont essentiels à la synthèse de la chlorophylle, et les plantes les puisent dans le sol.
Lorsque ces
éléments manquent, la chlorophylle n’est plus synthétisée et les feuilles perdent leur couleur verte.
Il est possible de lutter
contre la chlorose ferrique grâce à des moyens biologiques ; l’utilisation d’un purin d’ortie peut y contribuer par exemple.
Il est aussi possible d’utiliser des produits phytosanitaires commerciaux.
La teneur en fer d’un produit phytosanitaire
anti-chlorose est indiquée sur son emballage : 6,0 % en masse.
L’objectif de cet exercice est d’envisager un titrage par spectrophotométrie adapté au contrôle de qualité de ce produit.
Données : Masse molaire atomique du fer : MFe = 56,0 g.mol-1
Couples oxydant/réducteur : MnO4-/Mn2+ (incolore) ; S2O82-/SO42-(incolore)
Fe3+ (orange pâle)/Fe2+ (vert pâle)
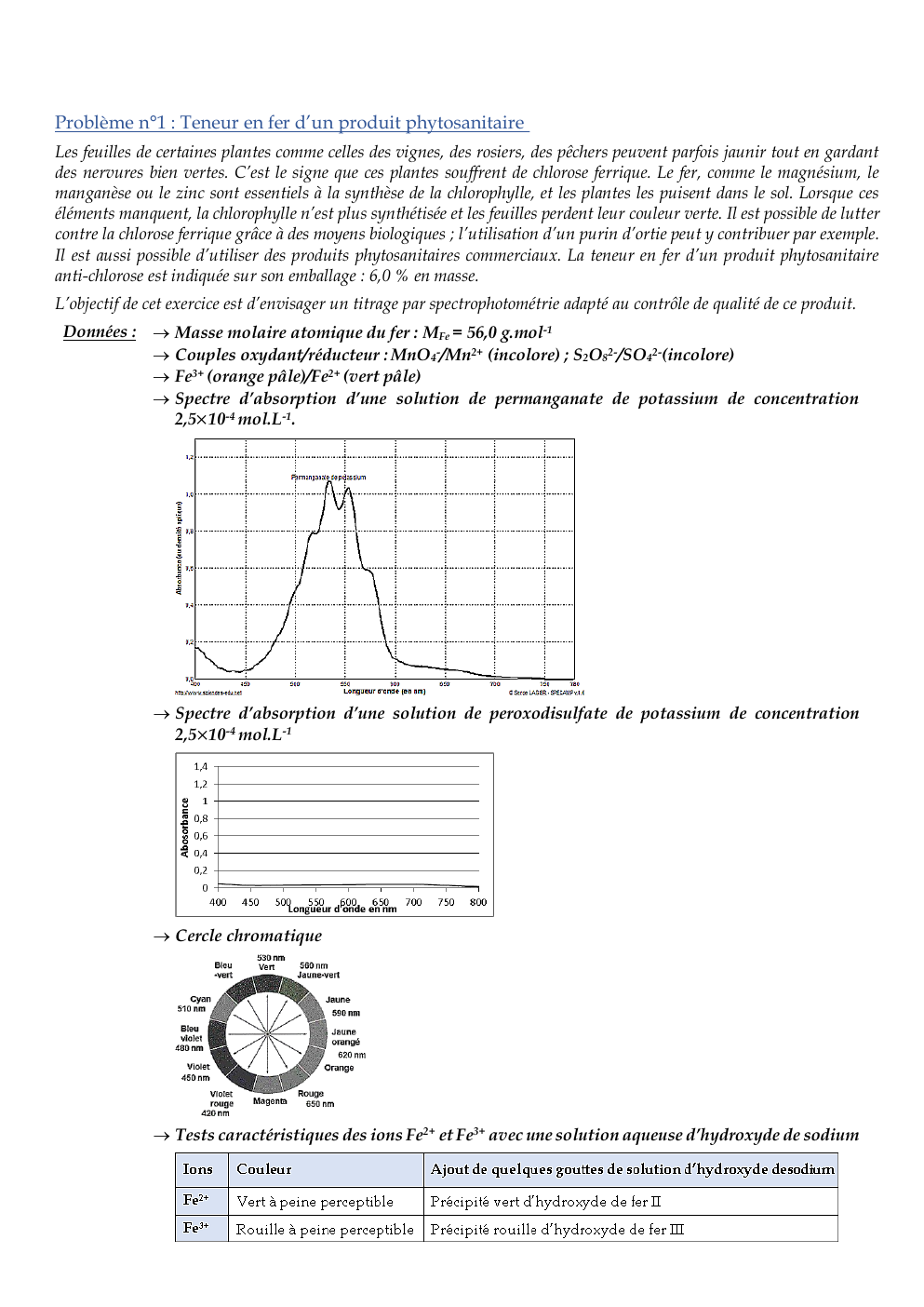
Spectre d’absorption d’une solution de permanganate de potassium de concentration
2,5×10-4 mol.L-1.
Spectre d’absorption d’une solution de peroxodisulfate de potassium de concentration
2,5×10-4 mol.L-1
Cercle chromatique
Tests caractéristiques des ions Fe2+ et Fe3+ avec une solution aqueuse d’hydroxyde de sodium
Partie 1 : choix du réactif titrant :
Pour réaliser le titrage des ions ferreux, Fe2+, contenus dans un produit phytosanitaire destiné à lutter contre la chlorose
ferrique, on dispose de deux solutions titrantes possibles :
Une solution de peroxodisulfate de potassium acidifiée (K +(aq)+S2O82-(aq)) de concentration 0,10 mol.L-1
Une solution de permanganate de potassium acidifiée (K+(aq)+MnO4-(aq)) de concentration molaire 0,10 mol.L-1.
Les ions peroxodisulfate comme les ions permanganate réagissent en solution aqueuse avec les ions Fe2+.
Un test avec une
solution aqueuse d’hydroxyde de sodium, après réaction entre les ions Fe2+ et les ions S2O82- ou MnO4-, conduit au même
précipité rouille d’hydroxyde de fer III.
1.
Préciser la nature de la transformation chimique qui se produit quand on mélange des ions Fe 2+ et des ions
peroxodisulfate S2O82- d’une part ou permanganate MnO4- d’autre part.
2.
Écrire les équations des réactions modélisant les transformations chimiques mettant en jeu :
les ions Fe2+ et les ions S2O82- d’une part,
les ions Fe2+ et les ions MnO4- d’autre part.
3.
Montrer, en vous référant à la couleur de chaque solution titrante, qu’il est plus judicieux de choisir la
solution de permanganate de potassium pour réaliser le titrage des ions ferreux contenus dans le produit
phytosanitaire, la coloration due aux ions ferreux (Fe2+) ou ferrique (Fe3+) en solution aqueuse étant très
peu perceptible.
4.
Définir l’équivalence d’un titrage.
Partie 2 : mise en œuvre du titrage :
5.
La solution de permanganate de potassium étant trop
concentrée, il est nécessaire de la diluer 5 fois avant de
l’utiliser pour le titrage.
Choisir, dans la liste de matériel
proposé (photographie ci-dessus), la verrerie adaptée à
cette dilution.
Justifier.
6.
Expliquer pourquoi certaines verreries sont associées à des
capacités notées 100 mL, 50 mL, 10 mL, et d’autres à des
capacités de 100,0 mL, 50,0 mL, 10,0 mL.
7.
Le produit phytosanitaire se présente sous la forme d’une poudre.
Afin de réaliser le titrage, on dissout
100,0 g de produit dans de l’eau et on complète avec de l’eau de façon à obtenir 1,0 L de solution.
a) On prélève 10,0 mL de cette solution qu’on introduit dans un erlenmeyer.
Dans la liste de matériel
proposée ci-dessus, choisir la verrerie utilisée pour prélever ces 10,0 mL.
b) Schématiser et légender le montage utilisé afin de réaliser le titrage.
Partie 3 : exploitation du résultat du titrage :
Le titrage est réalisé plusieurs fois.
On note VE, le volume de solution de permanganate de potassium versé pour atteindre
l’équivalence pour chaque titrage réalisé.
Les résultats sont rassemblés dans le tableau suivant :
Mesure
VE en mL
1
11,0
2
10,6
3
10,4
4
10,6
5
10,8
6
10,5
7
10,7
8
10,9
9
11,2
10
11,0
8.
L’incertitude-type u(VE), de type A, sur cette série de mesures est égale à 0,080 mL.
Écrire le résultat de la
mesure pour VE.
9.
Une autre méthode de détermination de l’incertitude-type sur le volume équivalent aurait pu être prise en
compte.
Préciser sa nature.
10.
Déterminer la teneur en masse d’ions ferreux présente dans l’échantillon de 10,0 mL de solution titrée
prélevé.
11.
Un titrage par spectrophotométrie peut-il être adapté au contrôle de la teneur en fer du produit
phytosanitaire indiquée sur l’emballage ?
Problème n°2 : l’eau oxygénée (E3C) :
Communément appelée « eau oxygénée », la solution aqueuse antiseptique est utilisée, notamment pour détruire les virus,
champignons et bactéries.
Son principe actif est le peroxyde d’hydrogène, de formule brute H2O2.
Le but de cet exercice
est de vérifier les indications figurant sur l’étiquette d’une solution commerciale d’eau oxygénée.
Etiquette d’une solution commerciale d’eau oxygénée S :
Données : Masse Molaire Moléculaire du peroxyde d’hydrogène : M(H2O2) = 34 g.mol-1
Le peroxyde d’hydrogène H2O2 contenu dans l’eau oxygénée peut être oxydé par les ions
permanganates MnO4- suivant la réaction d’oxydoréduction dont l’équation est la
suivante :
2 MnO4 –(aq) + 6 H+(aq) + 5 H2O2(aq) → 2 Mn2+(aq) + 8 H2O(l) + 5 O2(g)
Couples d’oxydoréduction mis en jeu : MnO4 –(aq) / Mn2+(aq)
O2 (g) /H2O2 (l)
Le titre T d’une eau oxygénée exprime le volume de dioxygène que peut libérer un litre d’eau
oxygénée en volume.
En effet, l’eau oxygénée en réagissant avec elle-même, libère du
dioxygène gazeux selon l’équation : 2 H2O2(aq) → 2 H2O(l) + O2(g)
Lors de cette réaction, H2O2 joue à la fois le rôle d’oxydant et de réducteur.
Le titre T est donné par la relation :
𝑻=
𝑪.𝑽𝒎
𝟐
C : concentration en quantité de matière en mol.L-1
Vm = 22,4 L.mol-1 : volume molaire d’un gaz (conditions normales de température et de
pression)
Spectre d’absorption obtenu au laboratoire d’une solution aqueuse de permanganate de
potassium :
Partie 1 : préparation de la solution à titrer :
Afin de procéder au titrage du peroxyde d’hydrogène contenue dans la solution commerciale par les ions permanganate,
la solution commerciale S est diluée dix fois pour obtenir la solution S’.
1.
Rédiger précisément le protocole à suivre pour réaliser cette dilution.
2.
Seuls les ions permanganate sont colorés en solution aqueuse.
Justifier cette propriété et préciser la couleur
de ces ions en solution aqueuse.
Partie 2 : titrage du peroxyde d’hydrogène par les ions permanganate :
Il est procédé au titrage d’oxydoréduction suivi par colorimétrie de V’=20,0 ± 0,05 mL de la solution S’ par une solution
de permanganate de potassium de concentration en quantité de matière égale à C 0 = (5,00 ± 0,2).10-2 mol.L-1.
Lors de ce
titrage colorimétrique, le volume obtenu à l’équivalence est de Véq = 13,7 ± 0,05 mL.
3.
Schématiser le montage expérimental utilisé en le légendant.
4.
Écrire les demi-équations électroniques mises en jeu lors du titrage permettant de retrouver l’équation de
la réaction d’oxydoréduction support du titrage.
5.
Définir l’équivalence et donner, à l’équivalence, la relation entre les quantités de matière des ions
permanganate introduits n(MnO4-(aq)) et du peroxyde d’hydrogène n(H2O2(aq)) initialement présent dans
l’échantillon titré.
6.
Comment l’équivalence est-elle repérée lors de ce titrage ?
7.
Déterminer C’, la concentration en quantité de matière du peroxyde d’hydrogène de la solution S’.
8.
L’incertitude relative sur C vaut U(C)=0,034 mol.L-1.Proposer un encadrement de la concentration en
quantité de matière C du peroxyde d’hydrogène de la solution commerciale S.
Partie 3 : conformité de la solution avec les indications de l’étiquette :
9.
Vérifier que la concentration Cétiquette en quantité de matière du peroxyde d’hydrogène indiquée sur
l’étiquette correspond à 0,88 mol.L-1.
10.
Les indications de l’étiquette correspondent-elles à la solution commerciale analysée ?
Partie 4 : efficacité d’une bouteille d’eau oxygénée ouverte depuis plusieurs mois :
Une bouteille d'eau oxygénée a été ouverte depuis plusieurs mois.
L'eau oxygénée peut réagir avec le dioxygène de l'air
et perdre ainsi toute ou une partie de ses propriétés antiseptiques.
On considère que....
»
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- L'art et la technique leçon+exercice philosophie
- Méthode texte 2022, exemple, exercice
- DM ENS PHYSIQUE Exercice 1 : « Des terres rares »
- SES exercice sur les marchés en concurence et sur les prix
- EXERCICE D’ECRITURE: avis sur Thérèse Raquin