Corrigé contrôle de physique chimie terminale
Publié le 26/02/2024
Extrait du document
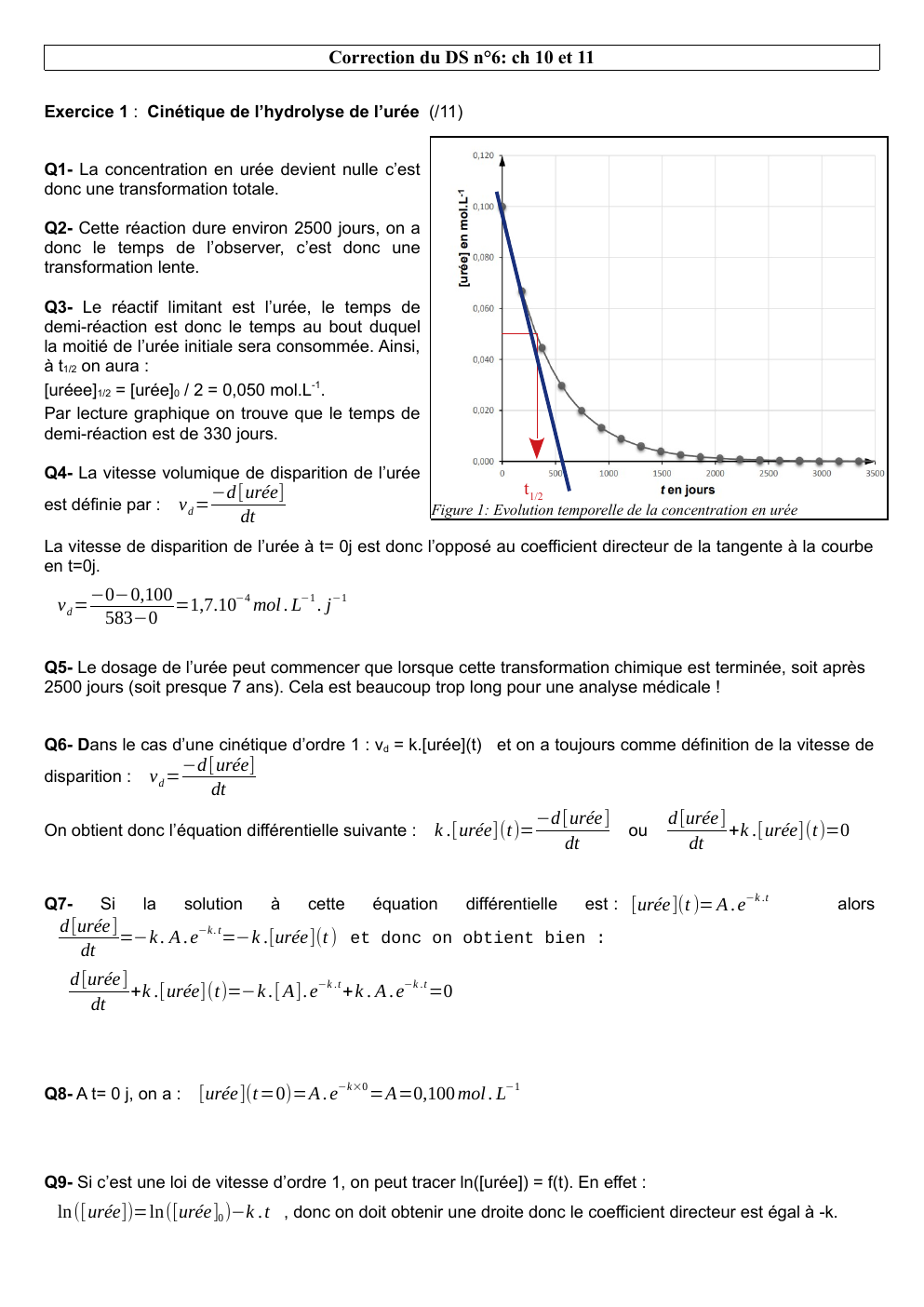
«
Correction du DS n°6: ch 10 et 11
Exercice 1 : Cinétique de l’hydrolyse de l’urée (/11)
Q1- La concentration en urée devient nulle c’est
donc une transformation totale.
Q2- Cette réaction dure environ 2500 jours, on a
donc le temps de l’observer, c’est donc une
transformation lente.
Q3- Le réactif limitant est l’urée, le temps de
demi-réaction est donc le temps au bout duquel
la moitié de l’urée initiale sera consommée.
Ainsi,
à t1/2 on aura :
[uréee]1/2 = [urée]0 / 2 = 0,050 mol.L-1.
Par lecture graphique on trouve que le temps de
demi-réaction est de 330 jours.
Q4- La vitesse volumique de disparition de l’urée
est définie par :
vd =
−d [urée]
dt
t1/2
Figure 1: Evolution temporelle de la concentration en urée
La vitesse de disparition de l’urée à t= 0j est donc l’opposé au coefficient directeur de la tangente à la courbe
en t=0j.
vd =
−0−0,100
=1,7.10−4 mol .
L−1 .
j −1
583−0
Q5- Le dosage de l’urée peut commencer que lorsque cette transformation chimique est terminée, soit après
2500 jours (soit presque 7 ans).
Cela est beaucoup trop long pour une analyse médicale !
Q6- Dans le cas d’une cinétique d’ordre 1 : vd = k.[urée](t) et on a toujours comme définition de la vitesse de
disparition :
vd =
−d [urée]
dt
On obtient donc l’équation différentielle suivante :
Q7-
Si
la
solution
à
cette
k .[urée](t)=
équation
−d [urée]
dt
différentielle
ou
d [urée ]
+k .[urée](t)=0
dt
−k .t
est : [urée ](t )= A .
e
alors
d [urée ]
=−k .
A .
e−k.
t=−k .[urée](t ) et donc on obtient bien :
dt
d [urée ]
−k .t
−k .t
+k .[urée](t)=−k .
[ A].
e + k .
A .
e =0
dt
Q8- A t= 0 j, on a :
[urée ](t =0)=A .
e−k×0 =A=0,100 mol .
L−1
Q9- Si c’est une loi de vitesse d’ordre 1, on peut tracer ln([urée]) = f(t).
En effet :
ln ([urée])=ln([urée]0 )−k .
t , donc on doit obtenir une droite donc le coefficient directeur est égal à -k.
t (en jours)
-1
[urée] (en mol.L )
ln([urée])
0
185
370
555
740
925
0,100
0,066
0,044
0,029
0,020
0,013
-2,3
-2,7
-3,1
-3,5
-3,9
-4,3
Lorsqu’on trace la courbe on obtient une droite d’équation : ln[urée] = -2,31 - 2,19.10-3 .t avec in coefficient de
corrélation de 0,9998.
Cette transformation suit bien une loi de vitesse d’ordre 1.
Q10- La valeur de la constante de vitesse 𝑘 de cette réaction est l’opposée du coefficient directeur de la
courbe obtenue précédemment, soit 2,19.10-3 j-1.
Q11- L’uréase n’est pas consommée à la fin de la transformation et elle permet d’augmenter la vitesse de la
réaction car la constante est bien plus grande.
L’uréase joue donc la rôle de catalyseur.
Q12- Pour comparer les échelles de temps :
- soit on compare directement les constantes de vitesse :
- soit on compare les temps de demi-réaction :
t 1 /2 , 2=
ln (2)
=8,7.10−11 jours
9
8,0.10
soit
t 1 /2 , 1=
k 2 8,0.109
=
=3,6.10 12
−3
k 1 2,2.10
ln(2)
=315 jours
2,2.10−3
t 1 /2,1
315
12
=
=3,6.10
t 1/2,2 8,7.10−7
La réaction avec l’uréase est 3,6.1012 fois plus rapide que sans.
Cela permet donc d’optimiser cette
transformation chimique
Exercice 2 : Pile ou accumulateur (/9)
Soit l’équation de réaction : Cd2+(aq) + Ni(s) Cd(s) + Ni2+(aq)
Q1- Quotient de réaction Qr de la réaction 1 :
Q2- Quotient de réaction Qr dans l’état initial :
Qr=
(réaction 1)
[Ni 2+ ]
2+
[Cd ]
Qr=
0,10
=1
0,10
Q3- On a Qr >K, donc la réaction se fera dans le sens indirect.
Q4- Demi-équations électroniques se produisant dans chaque demi-pile :
Cd (s) = Cd2+(aq) + 2e2+
-
Ni (aq) + 2 e = Ni(s)
C’est une oxydation
C’est une réduction.
Q5- L’électrode de nickel reçoit des électrons pour la réduction c’est donc le pôle positif, alors que l’électrode
de cadmium libère des électrons lors de l’oxydation, c’est donc le pôle négatif.
Q6- Le pont salin permet de fermer le circuit électrique et d’assurer l’électroneutralité des solutions grâce à la
migration des ions qu’il contient.
2.
L’accumulateur Ni-Cd d’un téléphone sans fil, première génération
Q7- Tableau d’avancement complété :
Q8- Le cadmium est le réactif limitant, on a donc : n0 – xf = 0
d’où
xf = n0
La quantité d’électron échangée vaut donc : ne = 2.xf = 2.n0
Q9- Quantité initiale de cadmium :
n0=
m
2,0
=
=0,018 mol
M 112,4
Capacité cet accumulateur : Q = z x xf x F = ne x F = 2 x n0 x F = 2 x 0,018 x 96 500 = 3 500 C
3.
L’accumulateur Ni-MH
Q10- Intensité nécessaire pour réaliser la charge en 15 minutes :
Q11- Durée de fonctionnement de cette pile :
Δ t=
Q 2900
=
=11 000 s=183 min≈3 h
I (0,27)
I=
Q
2900
=....
»
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- Corrigé physique chimie 1ère transformation
- chapitre de chimie de terminale spécialité physique réaction acide-base
- Physique Chimie, Chapitre 2 terminale, analyse d'un système chimique
- Corrigé contrôle matrice Terminale
- Grand Oral de Physique-Chimie : Améliorer les Imageries par Résonance Magnétique (IRM)